Bileşikleri Adlandırması 9. Sınıf Kimya
Kimyada adlandırma kurallarına geçmeden önce bazı elementlerin sembollerini ve bazı anyon/katyon taneciklerinin adlarını hatırlayıp öğrenelim.
Aşağıdaki tabloda periyodik cetveldeki ilk 20 elementin adları ve sembolleri verilmiştir:
| Element | Sembolü | Element | Sembolü |
|---|---|---|---|
| Hidrojen | H | Sodyum | Na |
| Helyum | He | Magnezyum | Mg |
| Lityum | Li | Alüminyum | Al |
| Berilyum | Be | Silisyum | Si |
| Bor | B | Fosfor | P |
| Karbon | C | Kükürt | S |
| Azot | N | Klor | Cl |
| Oksijen | O | Argon | Ar |
| Flor | F | Potasyum | K |
| Neon | Ne | Kalsiyum | Ca |
Bunların dışında günlük hayatta sık sık karşılaştığımız bazı element adları ve sembolleri de aşağıdaki gibidir:
| Element | Sembolü | Element | Sembolü |
|---|---|---|---|
| Bakır | Cu | Krom | Cr |
| Kurşun | Pb | Çinko | Zn |
| Mangan | Mn | Baryum | Ba |
| Brom | Br | Demir | Fe |
| Altın | Au | Gümüş | Ag |
| Kobalt | Co | Cıva | Hg |
| Kalay | Sn | Nikel | Ni |
| İyot | I | Platin | Pt |
İyonik Bağlı Bileşiklerin Sistematik Adlandırılması
İyonik bağlı bileşikler;
I) Metal-ametal,
II) Metal-kök,
III) Kök-kök,
IV) Kök-ametal
grupları arasında olabilir.
İyonik bileşikler adlandırılırken bazı sabit ve değişken değerlikli metaller ile sık kullanılan anyon ve katyonlar bilinmelidir.
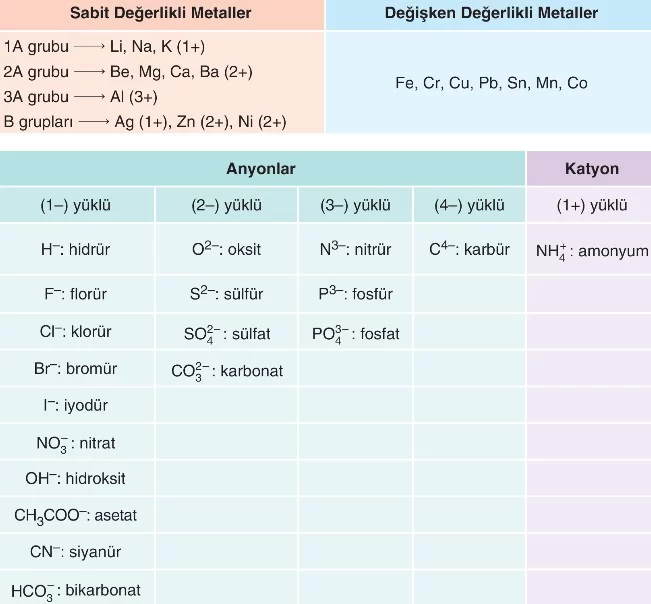
Adlandırma Kuralları
KURAL-1: (Sabit değerlikli metal-ametal)
- Önce metalin adı, ardından ametal iyon adı okunur.
Metal adı + Ametalin anyon adı
Örnekler:
| Bileşik | Adı |
|---|---|
| NaBr | Sodyum bromür |
| MgCl₂ | Magnezyum klorür |
| CaO | Kalsiyum oksit |
| Al₄C₃ | Alüminyum karbür |
| Na₃N | Sodyum nitrür |
| KF | Potasyum florür |
KURAL-2: (Değişken değerlikli metal-ametal)
- Metalin adından sonra metalin değerliği parantez içinde Roma rakamı ile yazılır.
Örnekler:
| Bileşik | Adı |
|---|---|
| FeCl₂ | Demir (II) klorür |
| Cu₂O | Bakır (I) oksit |
| HgO | Cıva (II) oksit |
| PbO₂ | Kurşun (IV) oksit |
| SnS | Kalay (II) sülfür |
KURAL-3: (Metal-kök)
- Önce metal adı ardından kök adı okunur.
Değişken değerlikli metalin yükü, iyonun yükü kullanılarak bulunabilir. Örneğin, CuSO₄ bileşiğinde SO₄²⁻ yükünden dolayı Cu²⁺ yüklüdür. Fe(OH)₃ bileşiğinde OH⁻ yükünden dolayı Fe³⁺ yüklüdür.
Örnekler:
| Bileşik | Adı |
|---|---|
| NaHCO₃ | Sodyum bikarbonat |
| KCN | Potasyum siyanür |
| Mg(NO₃)₂ | Magnezyum nitrat |
| Ca(OH)₂ | Kalsiyum hidroksit |
| Fe₂(CO₃)₃ | Demir (III) karbonat |
KURAL-4: (Kök-kök)
- Önce birinci kök adı sonra diğer kök adı okunur.
Örnekler:
| Bileşik | Adı |
|---|---|
| (NH₄)₂SO₄ | Amonyum sülfat |
| NH₄NO₃ | Amonyum nitrat |
KURAL-5: (Kök-ametal)
- Önce birinci kök adı, ardından ametal iyon adı okunur.
Örnekler:
| Bileşik | Adı |
|---|---|
| (NH₄)₂S | Amonyum sülfür |
| (NH₄)₃PO₄ | Amonyum fosfat |
Kovalent Bağlı Bileşiklerin Sistematik Adlandırılması
Kovalent bağlı bileşikler adlandırılırken bileşikteki atom sayıları Latince olarak belirtilir:
| Sayı | Latince | Sayı | Latince |
|---|---|---|---|
| 1 | mono | 6 | heksa |
| 2 | di | 7 | hepta |
| 3 | tri | 8 | okta |
| 4 | tetra | 9 | nona |
| 5 | penta | 10 | deka |
Formül adlandırılırken ilk atomun adı, ikinci atomun ise anyon adı okunur. Her atomun önünde o atomun moleküldeki sayısı Latince eklerle belirtilir. İlk atomun sayısı bir ise mono ek kullanılmaz. İkinci atomdaki sayı için mono ön eki kullanılır. Ayrıca oksit adı için mono, dioksit, trioksit ya da penta ön eki getirildiğinde eklentili son sessiz harf düşer; örneğin, monoksit, trioksit ve pentaoksit olarak adlandırılır. Örneğin, CO karbon monoksit.
Adlandırma kuralı:
- ametalin 1. ametalinin + 2. ametalinin sayısı + 1. ametal adı + 2. ametal adı
Örnekler:
- CO₂ : Karbondioksit
- N₂O₅ : Diazot pentaoksit
- NF₃ : Azot triflorür
- SO₃ : Sülfür trioksit
- H₂O : Dihidrojen monoksit
Adlandırma kuralları:
- Adlandırılan bileşiklerde elektronegatifliği düşük olan ametal önce okunur.
- Kovalent bileşiklerin adlandırılmasında moleküldeki elementin yanı adlandırmayı etkiler. Örneğin;
- N atomu 1. ametal ise nitrür,
- O atomu 2. ametal ise oksit,
- S atomu 1. ametal ise sülfür,
- C atomu 1. ametal ise karbon,
- H atomu 2. ametal ise hidrür olur.
Hidrojen bazı oksitlerde, su türevindeki bileşiklerde ametal olarak yazılır:
| Bileşik | Sistematik Adı |
|---|---|
| HCl | Hidrojen klorür |
| HNO₃ | Hidrojen nitrat |
| H₂SO₄ | Hidrojen sülfat (sülfürik asit) |
9. Sınıf Bileşikleri Adlandırması Konu anlatımı özet örnekler
Kimyada bileşiklerin adlandırılması, atomların birleşerek oluşturdukları yeni yapıları tanımlamak için kullanılan sistematik bir yöntemdir. Bu adlandırma, bileşiğin yapısını, içerdiği elementleri ve bu elementlerin oranlarını anlamayı kolaylaştırır. Bileşiklerin adlandırılması, iki ana kategoriye ayrılır: inorganik bileşiklerin adlandırılması ve organik bileşiklerin adlandırılması. Bu makalede, inorganik bileşiklerin adlandırılmasına odaklanacağız ve bu adlandırmanın temel kurallarını inceleyeceğiz.
İyonik Bileşiklerin Adlandırılması
İyonik bileşikler, bir metal ve bir ametal atomu arasındaki iyonik bağlarla oluşur. İyonik bileşiklerin adlandırılmasında temel kurallar şunlardır:
- Katyonun Adlandırılması: İyonik bileşiklerde, pozitif yüklü iyon (katyon) adı ilk olarak yazılır. Genellikle bir metal atomu olan katyonun adı, elementin adı ile aynıdır. Örneğin, sodyum iyonu (Na⁺) "sodyum" olarak adlandırılır.
- Anyonun Adlandırılması: Negatif yüklü iyonun (anyon) adı ise ikinci olarak yazılır. Anyonun adı, elementin köküne "-ür" veya "-ürür" eki eklenerek adlandırılır. Örneğin, klor (Cl⁻) "klorür" olarak adlandırılır.
- Bileşiğin Adı: Bileşiğin adı, katyonun adı ile başlar ve ardından anyonun adı gelir. Örneğin, NaCl bileşiği "sodyum klorür" olarak adlandırılır.
Moleküler (Kovalent) Bileşiklerin Adlandırılması
Moleküler bileşikler, genellikle ametal atomlarının kovalent bağlarla birleşmesiyle oluşur. Bu bileşiklerin adlandırılmasında ise aşağıdaki kurallar izlenir:
- Elementlerin Sayısı: İlk elementin adı aynen yazılır ve ardından ikinci elementin adının köküne "-ür" eki eklenir. Her iki elementin de sayısını belirten ön ekler kullanılır (mono-, di-, tri-, vb.). Ancak, ilk elementin sayısı 1 ise "mono-" ön eki genellikle yazılmaz. Örneğin, CO bileşiği "karbon monoksit" olarak adlandırılır.
- Çoklu Bağlar: Eğer molekülde birden fazla aynı element varsa, ön ekler kullanılarak bu durum belirtilir. Örneğin, N₂O₄ bileşiği "diazot tetroksit" olarak adlandırılır.
Asitlerin Adlandırılması
Asitler, su içinde çözündüklerinde hidrojen iyonları (H⁺) veren bileşiklerdir. Asitlerin adlandırılması, bileşiğin içindeki anyonun türüne göre yapılır:
- Oksijen İçermeyen Asitler: Eğer asit oksijen içermiyorsa, "hidro-" öneki ile başlar ve anyonun adının köküne "-ik" eki eklenir. Örneğin, HCl "hidroklorik asit" olarak adlandırılır.
- Oksijen İçeren Asitler: Eğer asit oksijen içeriyorsa, anyonun adının köküne "-ik" veya "-öz" eki eklenir. Örneğin, H₂SO₄ "sülfürik asit" olarak adlandırılır.
Bazlar ve Tuzlar
Bazlar, hidroksit iyonu (OH⁻) içeren bileşiklerdir ve adlandırılmaları katyonun adı ile "hidroksit" kelimesi birleştirilerek yapılır. Örneğin, NaOH "sodyum hidroksit" olarak adlandırılır. Tuzlar ise, bir asidin hidrojen iyonu ile bir bazın hidroksit iyonunun yer değiştirmesi sonucu oluşan bileşiklerdir. Tuzların adlandırılması, iyonik bileşiklerin adlandırılması ile aynıdır.
Özel Durumlar ve İstisnalar
- Bazı bileşiklerin özel adları vardır: Su (H₂O), amonyak (NH₃) gibi bazı bileşikler, sistematik adlandırma kurallarına uymayan özel adlarla bilinir.
- Asitler: Hidrojen içeren ve sulu çözeltide H+ iyonu veren bileşiklerdir. Adlandırma kuralları farklıdır.
- Bazlar: Hidroksit iyonu (OH-) içeren bileşiklerdir. Adlandırma kuralları farklıdır.
Bileşiklerin adlandırılması, kimyada temel bir konudur ve doğru adlandırma, bileşiklerin yapısını ve özelliklerini anlamada kritik bir rol oynar. İyonik ve kovalent bileşiklerin adlandırılması, asitler, bazlar ve tuzlar gibi çeşitli kimyasal bileşiklerin sistematik olarak tanımlanmasını sağlar.