Kovalent Bağ 9. Sınıf Kimya
Bileşiği oluşturacak elementlerin elektronegatiflikleri ve iyonlaşma enerjileri arasındaki fark, elementler arasında oluşacak bağın türünü belirlemektedir. Elektronegatiflik ve iyonlaşma enerjileri arasındaki fark birbirine yakın olan atomlar arasında elektron ortaklaşmasına dayalı bağ oluşur.
Aynı ya da farklı tür ametal atomları arasında elektron ortaklaşması ile gerçekleşen kimyasal bağa kovalent bağ denir. Kovalan bağ ile oluşan bileşiklere de kovalent bileşikler veya moleküler bileşikler denir.
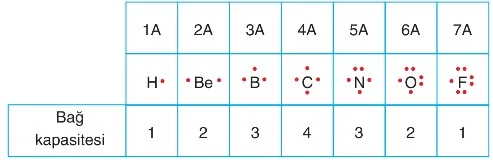
- Bir atomun bağ yapma kapasitesi Lewis sembolündeki tekli elektron sayısı kadardır. Buna göre, aşağıdaki tabloda bazı grup elementlerinin bağ yapma kapasiteleri verilmiştir.
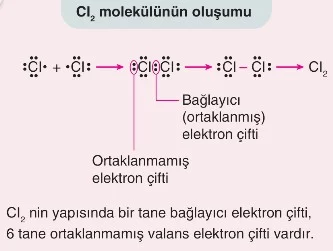
- İki ametal atomu arasında ortaklaşa kullanılan bir çift valans elektronu bir kovalent bağı oluşturur ve çizgi (−) ile gösterilir.
- Lewis yapısında ortaklaşa kullanılan valans elektron çiftlerine bağlayıcı (ortaklanmış) elektron çifti, bağ oluşumuna katılmayan valans elektron çiftlerine ortaklanmamış elektron çifti denir.
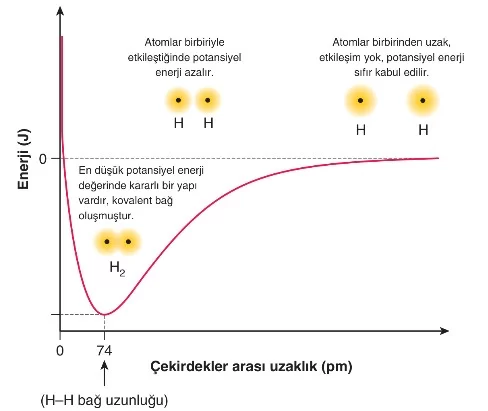
Örneğin, iki hidrojen atomunun birbirine yaklaşması durumunda oluşan itme ve çekme kuvvetleri aşağıdaki görselle verilmiştir.
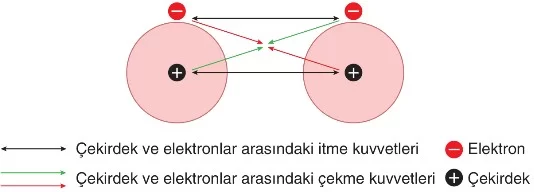
Yukarıdaki görsele göre, atomlar birbirine yaklaştığında, i) Elektronlar birbirini iter,
ii) Çekirdekler birbirini iter,
iii) Atom çekirdekleri elektronları çeker.
Bu sırada sistemin potansiyel enerji değişimi grafiği aşağıdaki gibidir.
Kovalent Bağda Atomları Bir Arada Tutan Şey Nedir?
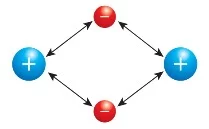
Kovalent bağda atomları bir arada tutan şey ortaklaşa kullanılan elektron çiftleri ile pozitif yüklü atom çekirdeği arasındaki elektrostatik çekim kuvvetidir.
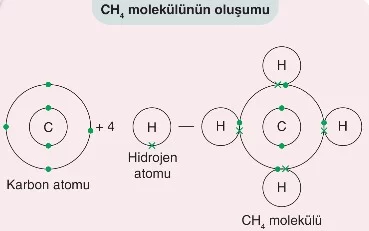

Molekülde en çok bağ yapan atom, merkez atom olarak belirtilir. Örneğin, CO₂ molekülünde C atomu, NH₃ molekülünde N atomu merkez atomdur.
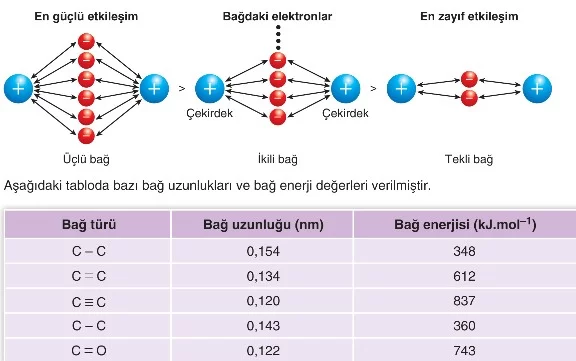
İki atom arasındaki bağ sayısı arttıkça bağ uzunluğu ve bağ kuvveti nasıl değişir?
İki atom arasındaki ortaklaşılan elektron sayısı arttıkça (bağ sayısı arttıkça) çekirdek ve elektronlar arasındaki çekim kuvveti de artacaktır. Bu nedenle bağ kuvveti artarken, bağ uzunluğu da azalacaktır.
9. Sınıf Kovalent Bağ Konu Anlatımı Özet Örnekler Ders Notları
Kovalent bağ, kimyanın temel kavramlarından biridir ve atomlar arasında elektronların paylaşılması yoluyla oluşur. Bu bağ türü, genellikle ametal atomları arasında meydana gelir ve birçok bileşiğin oluşumunda rol oynar. Kovalent bağ, moleküllerin yapı taşlarını oluşturarak, bileşiklerin fiziksel ve kimyasal özelliklerini belirler. Bu makalede, kovalent bağın nasıl oluştuğunu, bu bağın türlerini ve kovalent bileşiklerin temel özelliklerini inceleyeceğiz.
Kovalent Bağın Oluşumu
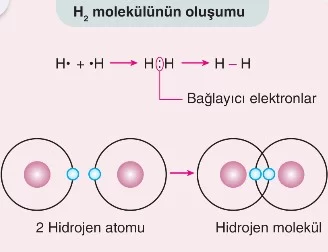
Kovalent bağ, iki atomun dış enerji seviyelerindeki elektronlarını ortaklaşa kullanarak kararlı bir yapı oluşturmasıyla meydana gelir. Bu paylaşım, her iki atomun da kararlı bir elektron düzenine ulaşmasını sağlar. Örneğin, iki hidrojen atomu (H) birer elektron paylaşarak H₂ molekülünü oluşturur. Bu paylaşım, atomlar arasında güçlü bir çekim kuvveti yaratır ve bu kuvvet atomları bir arada tutar.
Kovalent Bağın Türleri
- Tekli Kovalent Bağ: İki atom arasında bir çift elektronun paylaşılmasıyla oluşur. Örneğin, hidrojen molekülünde (H₂), iki hidrojen atomu bir çift elektron paylaşır.
- Çift Kovalent Bağ: İki atom arasında iki çift elektronun paylaşılmasıyla oluşur. Örneğin, oksijen molekülünde (O₂), iki oksijen atomu iki çift elektron paylaşarak çift kovalent bağ oluşturur.
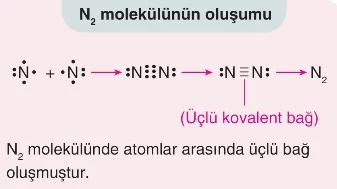
- Üçlü Kovalent Bağ: İki atom arasında üç çift elektronun paylaşılmasıyla oluşur. Örneğin, nitrojen molekülünde (N₂), iki nitrojen atomu üç çift elektron paylaşarak üçlü kovalent bağ oluşturur.
Polar ve Apolar Kovalent Bağlar
- Polar Kovalent Bağ: Elektronların iki atom arasında eşit olmayan bir şekilde paylaşılması sonucu oluşur. Bu durumda, daha elektronegatif atom, ortak elektronları kendisine daha yakın tutar. Örneğin, su (H₂O) molekülünde oksijen atomu, hidrojen atomlarına göre daha elektronegatif olduğu için, elektronlar oksijene daha yakın olur.
- Apolar Kovalent Bağ: Elektronların iki atom arasında eşit olarak paylaşılmasıyla oluşur. Bu tür bağlar, genellikle aynı elementin atomları arasında meydana gelir. Örneğin, oksijen molekülünde (O₂) elektronlar her iki oksijen atomu tarafından eşit olarak paylaşılır.
Kovalent Bileşiklerin Özellikleri
- Düşük Erime ve Kaynama Noktaları: Kovalent bileşikler, genellikle düşük erime ve kaynama noktalarına sahiptir. Bunun nedeni, kovalent bağların nispeten zayıf olmasıdır.
- Elektriksel İletkenlik: Kovalent bileşikler, genellikle elektrik akımını iletmezler, çünkü serbest elektronları yoktur.
- Çözünürlük: Polar kovalent bileşikler, genellikle su gibi polar çözücülerde çözünürken, apolar kovalent bileşikler apolar çözücülerde çözünür.
Kovalent Bağın Örnekleri
- Su (H₂O): İki hidrojen atomu ile bir oksijen atomu arasında kovalent bağlar oluşur. Oksijen, hidrojen atomlarının elektronlarını paylaşarak su molekülünü oluşturur.
- Metan (CH₄): Bir karbon atomu, dört hidrojen atomu ile kovalent bağlar yaparak metan molekülünü oluşturur.
Kovalent bağ, birçok bileşiğin temelini oluşturan önemli bir kimyasal bağ türüdür. Atomlar arasında elektronların paylaşılması yoluyla oluşan bu bağ, bileşiklerin fiziksel ve kimyasal özelliklerini belirler. Kovalent bağın özelliklerini anlamak, kimyanın diğer alanlarındaki kavramları ve bileşiklerin davranışlarını anlamada önemli bir adım oluşturur.