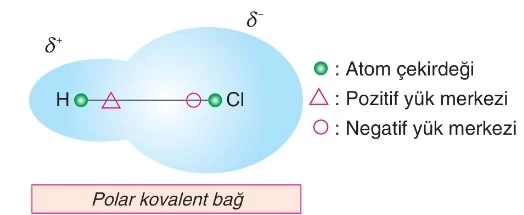
Molekül Polarlığı ve Apolarlığı 9. Sınıf Kimya
Kovalent bağ ikiye ayrılır:
- Polar Kovalent Bağ
- Apolar Kovalent Bağ
1. Polar Kovalent Bağ
Farklı tür ametal atomları arasında oluşan kovalent bağdaki elektronlar elektronegatifliği fazla olan atom tarafından daha çok çekilir. Bu tip kovalent bağa polar (kutuplu) kovalent bağ denir.
HCl molekülünde elektronegatiflik değeri yüksek olduğu için elektron yoğunluğu Cl atomuna yakındır. Bu nedenle bağın Cl tarafı kısmen negatif özellik gösterirken (δ⁻), H tarafı kısmen pozitif (δ⁺) özellik gösterir ve bağ polar olur.
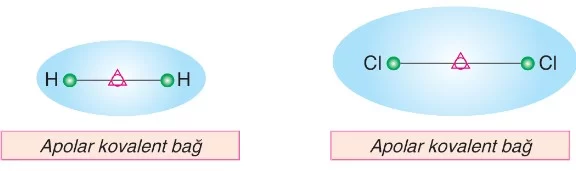
2. Apolar Kovalent Bağ
Aynı cins iki ametal atomunun elektronlarını ortaklaşa kullanmasıyla oluşan kovalent bağda, elektronlar her atom çekirdeği tarafından eşit oranda çekilir. Bu tip kovalent bağa apolar (kutupsuz) kovalent bağ denir.
Moleküllerde Polarlık / Apolarlık
Molekülün Lewis yapısı, o molekülün polar ya da apolar yapılı olduğu hakkında bilgi verir.
- Bir molekülde bulunan atomların kısmi elektriksel çekim kuvvetleri birbirini dengeler ise bu molekül kutupsuz yani apolar yapılır. Bu nedenle, apolar moleküller simetrik yapılırdır.
Örneğin, H₂ molekülü apolar yapılır. 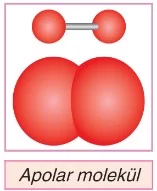
- Eğer molekülde elektron yük dağılımı dengeli değilse ve bir atom üzerinde yoğunlaşmışsa bu durumda elektron yük yoğunluğunun çok olduğu tarafta kalıcı negatif kutup, diğer tarafta da kalıcı pozitif kutup oluşacağı için molekül kutuplu yani polar yapılır.
- İki atomlu moleküllerde bağ polarlığı ile molekül polarlığı aynıdır. Örneğin, H₂, O₂, N₂ gibi moleküllerde hem bağ hem de molekül apolar yapılır. HCl, HF, CO gibi moleküllerde hem bağ hem de molekül polar yapılır.
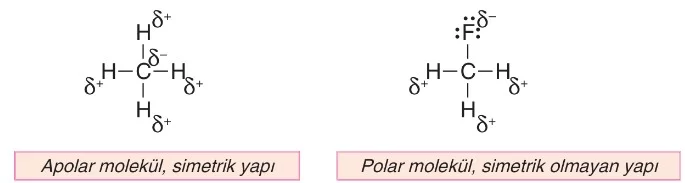
- C atomunun aynı element atomları ile 4 bağ yaptığı bileşikler (CH₄, CCl₄ gibi) apolar yapılı olup atomlardan en az biri farklı ise (CHCl₃, CH₃F gibi) molekül polar yapılır.
- CO₂ molekülü apolar yapılır.
Bağ: Polar kovalent
Molekül: Apolar 
- Merkez atom üzerinde ortaklanmamış valans elektron çifti içeren moleküller polardır. Örneğin, aşağıda Lewis yapıları verilen H₂O ve NH₃ molekülleri polar yapılır.
Bağ: Polar kovalent
Molekül: Polar 
- Yapısında sadece C ve H atomlarını içeren bileşikler hidrokarbon olarak bilinirler ve hidrokarbonlar (örneğin; CH₄, C₃H₈, C₅H₁₂, C₆H₆…) apolar yapılır.
Bağ: 6 polar kovalent bağ; 1 apolar kovalent bağ
Molekül: Apolar 
- B aynı element atomları ile 3 bağ yaptığında, BH₃ gibi, molekül apolar yapılır.
Bağ: Polar kovalent
Molekül: Apolar 
- “Benzer benzere çözer” ilkesine göre polar moleküller ve iyonik yapılı bileşikler polar çözücülerde, apolar moleküller de apolar çözücülerde iyi çözünürler.
Örneğin, apolar yapılı I₂ molekülü, polar yapılı H₂O‘da çözünmezken, apolar yapılı C₆H₆ çözücüsünde çözünür.
9. Sınıf Molekül Polarlığı ve Apolarlığı konu anlatımı özet örnekler
Moleküller, atomların kimyasal bağlar oluşturarak birleştiği yapılar olarak bilinir. Bu bağlar sırasında elektronların nasıl paylaşıldığı, molekülün genel polar veya apolar bir özellik gösterip göstermediğini belirler. Polarlık, molekülün elektriksel yük dağılımının simetrik olup olmamasına bağlıdır ve bu, molekülün fiziksel ve kimyasal özelliklerini önemli ölçüde etkiler. Bu makalede, molekül polarlığının ne olduğunu, nasıl belirlendiğini ve apolar moleküllerden nasıl farklılaştığını inceleyeceğiz.
Molekül Polarlığı Nedir?
Bir molekülün polarlığı, atomlar arasındaki elektronların nasıl paylaşıldığına bağlıdır. Eğer bir moleküldeki elektronlar eşit olarak paylaşılmamışsa, yani elektron yoğunluğu molekülün bir tarafında daha fazlaysa, bu molekül polar olarak adlandırılır. Polar moleküllerde, bir tarafı kısmi negatif yük (δ⁻), diğer tarafı ise kısmi pozitif yük (δ⁺) taşır. Bu durum, molekülün dipol momentine sahip olmasına neden olur.
Polar Moleküller
Polar moleküller, genellikle farklı elektronegatifliğe sahip atomların oluşturduğu kovalent bağlardan oluşur. Elektronegatifliği daha yüksek olan atom, bağ elektronlarını kendine doğru çeker, bu da molekülün bir ucunun daha negatif, diğer ucunun ise daha pozitif olmasına yol açar. Örneğin:
- Su (H₂O): Oksijen atomu, hidrojen atomlarına göre daha elektronegatiftir, bu yüzden elektronlar oksijene daha yakındır. Bu, su molekülünün polar olmasına neden olur.
- Hidrojen Florür (HF): Flor atomu, hidrojen atomuna göre çok daha elektronegatiftir, bu yüzden elektronlar flor atomuna doğru çekilir ve HF molekülü polar hale gelir.
Molekülü Polar Yapan Nedir?
- Farklı elektronegatiflikte atomlar: Bir moleküldeki atomların elektronegatiflikleri farklıysa, ortaklaşa kullanılan elektron çifti daha elektronegatif olan atoma doğru çekilir. Bu durum, molekülde kısmi yük ayrılması oluşturur ve molekülü polar yapar.
- Asimetrik molekül geometrisi: Molekülün geometrisi simetrik değilse, yani kutuplar birbirini götürmezse, molekül polar olur.
Apolar Moleküller
Apolar moleküller, atomlar arasındaki elektronların eşit olarak paylaşıldığı moleküllerdir. Bu durumda, molekülün içinde belirgin bir kısmi yük farkı oluşmaz. Apolar moleküller genellikle aynı elementten oluşan atomlar arasında veya simetrik yapıya sahip moleküllerde görülür. Örneğin:
- Karbon Dioksit (CO₂): Molekülün doğrusal yapısı nedeniyle, oksijen atomları arasındaki çekim kuvvetleri birbirini dengeler ve CO₂ molekülü apolar olur.
- Metan (CH₄): Karbon atomu ile dört hidrojen atomu arasındaki bağlar simetriktir ve molekül apolar olarak kabul edilir.
Molekülü Apolar Yapan Nedir?
- Aynı elektronegatiflikte atomlar: Moleküldeki tüm atomların elektronegatifliği aynı ise, ortaklaşa kullanılan elektron çifti eşit olarak paylaşılır ve molekül apolar olur.
- Simetrik molekül geometrisi: Molekülün geometrisi simetrik ise, yani kutuplar birbirini götürürse, molekül apolar olur.
Örnekler
- Polar Molekül: Su (H₂O) molekülü, oksijen atomu daha elektronegatif olduğu için elektron çiftleri oksijene doğru çekilir. Bu durum, oksijen atomu çevresinde kısmi negatif, hidrojen atomları çevresinde ise kısmi pozitif yükler oluşturur. Molekülün bükülmüş geometrisi de polariteyi artırır.
- Apolar Molekül: Karbondioksit (CO₂) molekülü, doğrusal bir geometriye sahiptir ve karbon ve oksijen atomlarının elektronegatiflikleri birbirine yakın olduğu için molekül apolardir.
Polarlık ve Apolarlığın Moleküller Üzerindeki Etkisi
Moleküllerin polar veya apolar olması, onların fiziksel ve kimyasal özelliklerini önemli ölçüde etkiler:
- Çözünürlük: "Benzer benzeri çözer" prensibine göre, polar moleküller genellikle polar çözücülerde (örneğin su) iyi çözünürken, apolar moleküller apolar çözücülerde (örneğin benzen) iyi çözünür.
- Kaynama ve Erime Noktaları: Polar moleküller arasında oluşan dipol-dipol etkileşimleri, bu moleküllerin kaynama ve erime noktalarını yükseltir. Apolar moleküller ise genellikle daha düşük kaynama ve erime noktalarına sahiptir.
Polarlık ve Apolarlığın Önemi
- Çözünme: Polar moleküller genellikle polar çözücülerde (su gibi), apolar moleküller ise apolar çözücülerde (benzen gibi) çözünür. Bu durum, "benzer benzeri çözer" prensibine dayanır.
- Kaynama noktası: Polar moleküller arasında daha güçlü çekim kuvvetleri olduğu için, apolar moleküllere göre genellikle daha yüksek kaynama noktalarına sahiptirler.
- Biyolojik sistemler: Su, canlılar için temel bir çözücü olduğu için, suda çözünen polar moleküller biyolojik süreçlerde önemli bir rol oynar.
Molekül polarlığı, kimyada önemli bir kavramdır ve moleküllerin kimyasal bağlarının doğasını ve moleküllerin etkileşimlerini anlamak için kritik bir rol oynar. Polarlık ve apolarlık, moleküllerin fiziksel özelliklerini belirlemede büyük öneme sahiptir ve kimyasal reaksiyonların nasıl gerçekleşeceği üzerinde doğrudan bir etkiye sahiptir.